
Rak przewodowy sutka wybarwiony przeciwciałem przeciwko HER2; CC BY-SA 3.0, autor nieznany, Wikipedia
Obok tego istnieją dziesiątki białek, które kojarzymy dość mgliście, wiedząc – oczywiście – jednocześnie kiedy i w jakim celu należy je zbadać. Ot, takie CDX2 na przykład. Przeciwciało przeciwko CDX2 jest bardzo przydatne. W zestawie z paroma innymi bywa nieocenione, gdy chcemy się upewnić czy dany rak wywodzi się z nabłonka jelitowego (z nabłonka jelita grubego zwłaszcza), ale nie wydaje mi się, by wiedza o tym, co konkretnie CDX2 robi w organizmie była jakoś szczególnie powszechna. Dla większości z nas jest to (właściwie nie tyle “to”, ile przeciwciało przeciwko “temu”) po prostu Białko, Które Barwi Jelito. Podobnie będzie na przykład z TTF1, Białkiem, Które barwi Się W Tarczycy, Ale I W Płucu. I nie, nie jest to żaden zarzut wobec kolegów i koleżanek po fachu. Nie jest to bynajmniej wiedza jakoś szczególnie przydatna w praktyce – tak naprawdę w naszej codziennej pracy musimy wiedzieć “tylko” co, jak i w jakiej sytuacji się wybarwi. I umieć wyciągnąć z tego wnioski. “Dlaczego” bywa tu oczywiście fajnym dodatkowym smaczkiem, ale nie jest niezbędne.
Ha, ale właśnie. “Dlaczego” i “co konkretnie robi”, choć nie są pytaniami w pracy patologów niezbędnymi, są jednocześnie tym, co dodaje smaku nieco nudnawym niekiedy niezbędnym w pracy wyliczankom. Poza tym zawsze fajnie jest wiedzieć więcej. Zwłaszcza gdy chodzi o białko tak bardzo dla patologów istotne, jak Ki-67. Najprościej mówiąc, jest Ki-67 markerem proliferacji, czyli mówi nam o tym, że komórki, w których Ki-67 wykrywamy, dzielą się. A że jedną z istotniejszych cech większości nowotworów jest ich niekontrolowane intensywne namnażanie się właśnie, sami na pewno rozumiecie, jak przydatna może być w codziennej pracy możliwość w miarę obiektywnej oceny skali tego namnażania się w poszczególnych zmianach. Pomaga nam to, zależnie od sytuacji, rozpoznawać niektóre nowotwory i zmiany przednowotworowe, odróżniać poszczególne nowotwory od siebie, jak i oceniać jak bardzo agresywnie będzie się dana zmiana zachowywać. Ki-67 jest głównym bohaterem rozlicznych patologicznych tabelek, skal i wytycznych. Nie rozpoznaje się raka neuroendokrynnego przewodu pokarmowego bez wybarwienia preparatów i oceny poziomu tego białka, nie stawia się rozpoznania rakowiaka płuca ani raka drobnokomórkowego. A rak sutka? chłoniaki? glejaki? Ki-67 to nieodłączny towarzysz patologów. Ale patolodzy niewiele wiedzą o swoim immunohistochemicznym przyjacielu. A w każdym razie niewiele wiedzieli.
Choć mamy do czynienia z białkiem opisywanym w patomorfologii od wczesnych lat osiemdziesiątych, tak naprawdę o jego funkcji do zeszłego tygodnia mało mogliśmy powiedzieć, niezależnie od poziomu naszej dociekliwości i dobrych chęci. Co się zatem w zeszłym tygodniu zmieniło? Otóż 29 czerwca czasopismo Nature opublikowało pracę szczegółowo zajmującą się właśnie funkcją Ki-67. Nie mogłam się nie zachwycić. I nie mogłam się nie podzielić.
Ki-67 jest białkiem, którego (z pewnymi nielicznymi wyjątkami) poszukujemy w jądrze komórkowym. Od jakiegoś czasu wiemy też (a w każdym razie mogą wiedzieć ci, którym chce się trochę za tą wiedzą pogrzebać), że w tym jądrze Ki zwykło lokalizować się na powierzchni chromosomów. Ale po co? Na to pytanie odpowiedzi dostarczyły dopiero Sara Cuylen i Claudia Blaukopf z wiedeńskiego Institut für Molekulare Biotechnologie wraz z resztą ekipy badawczej.
Żeby rzecz wyjaśnić zapewne należałoby się odrobinę cofnąć. Wspomniałam, że Ki-67 układa się podczas podziału komórki na powierzchni chromosomów. Ale czy wiecie czym są chromosomy? Zapewne hasło to wywołuje z pamięci podręcznikowe rządki lub grupki zgrabnych “iksów”, prawda? Czasem uporządkowanych w elegancki zestaw nazywany kariogramem, a przedstawiający komplet chromosomów danej komórki. Prawidłowe skojarzenie. Ale też nie powinniśmy zapominać, że przez większą część życia komórki jej DNA wcale nie jest upakowane w takie zgrabne regularne “iksiki”.
Zajmująca pomiędzy ewentualnymi podziałami komórkowymi (w tak zwanej interfazie) jądro komórkowe chromatyna, kompleks DNA i pomagających je upakować białek (pamiętajcie, w takim niewielkim w końcu, kilkumikrometrowej zazwyczaj średnicy, jądrze komórkowym trzeba upchać około dwóch metrów nici DNA), tworzy draperie i festony ciaśniej czy luźniej pozbijanych pętli i zwojów. Pod mikroskopem świetlnym obserwujemy w tym czasie jedynie niejednorodną, mniej czy bardziej ziarnistą, rozproszoną “masę”.
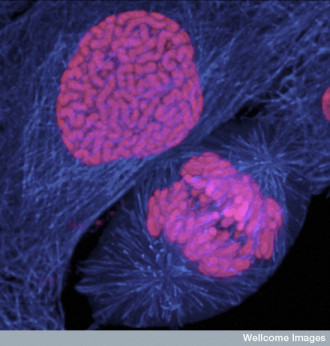
Te pomieszane zwały chromatyny gdy nadchodzi czas podziału komórki, kiedy rozpoczyna się mitoza, kondensują się, przybierając ostatecznie postać zupełnie odrębnych, oddzielonych od siebie struktur, znacznie bardziej zbitych i upakowanych chromosomów. Chromosomy takie (tak, te “iksy” właśnie, które kojarzycie z podręczników) zbudowane są zasadniczo z tych samych składników, co opisane zwoje chromatyny – są tylko ściślej upchnięte. Cały proces zachodzi stopniowo, przechodząc przez kolejne stadia mitozy, od profazy z dopiero wyodrębniającymi się i kondensującymi chromosomami poczynając, po metafazę, w której chromosomy przyjmują swą “kanoniczną” książkową formę i anafazę, gdzie rozdzielają się, tworząc chromosomy potomne, by zakończyć proces podziału komórki telofazą (tak, wiem, to trochę skomplikowane – być może powinna kiedyś powstać osobna, poświęcona tylko mitozie notka). Tylko gdzie tu miejsce na nasze nieszczęsne Ki-67? Ha, w centrum jednej z zagadek nadal czających się pośród mechanizmów sterujących mitozą.
Podkreśliłam wyżej, że istotną częścią najwcześniejszej fazy mitozy jest kondensacja i wyodrębnienie się chromosomów jako oddzielnych struktur (tak by móc je następnie porządnie i po równo porozdzielać pomiędzy komórki potomne). Ale zaraz. Chwila. Co właściwie sprawia, że chromosomy pozostają osobnymi chromosomami zamiast posklejać się w bezkształtną chromatynową masę? W końcu biochemicznie poszczególne chromosomy niczym szczególnym się od siebie nie różnią. Związki odpowiedzialne za ich upakowanie nijak nie są w stanie odróżnić ich od siebie – ot, tu DNA i białka, tam DNA i białka. I tyle. Dlaczego zatem ładne osobne “iksy”, a nie zbity niekształtny kleks sklejony z upakowanych “iksów”? Taaak. To nie będzie dla was niespodzianka. Oczywiście, że tajemniczym antykleksowym czynnikiem będzie nasze tytułowe białko. Bez niego niekształtnym zbitym kleksem właśnie zakończy się próba uporządkowania chromosomów – ładnie widać to na udostępnionym przez Institut für Molekulare Biotechnologie filmiku (komórka po prawej pozbawiona jest właśnie Ki-67).
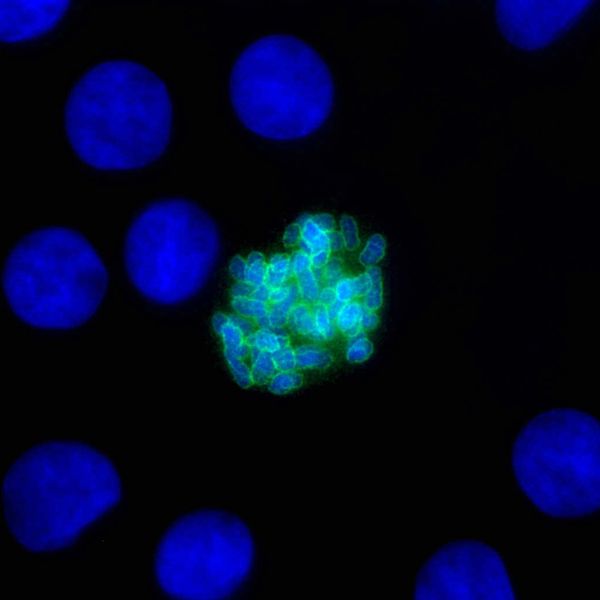
Otóż Ki-67 (jak widać zresztą na jednym z wcześniejszych obrazków) gromadzi się na powierzchni chromosomów.
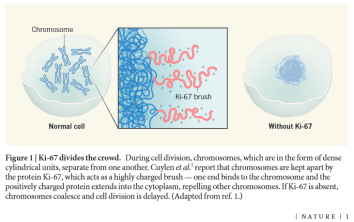
Tak szczecinkę z Ki widzą autorzy omówienia pracy Cuylen z najnowszego Nature – http://www.nature.com/nature/journal/vaop/ncurrent/full/nature18904.html
Ale jeśli przyjrzeć się bliżej, nader istotny okaże się sposób, w jaki się na tej powierzchni gromadzi. Oddajmy w tej kwestii głos Sarze Cuylen, pierwszej autorce publikacji z Nature:
…jeden z końców białka Ki-67 przyciągany jest do chromosomu, podczas gdy drugi odsuwa się od niego. W rezultacie cząsteczki Ki-67 tworzą nieco wydłużone szczecinowate struktury na powierzchni chromosomów – de facto coś w rodzaju oddzielającej chromosomy od siebie bariery.
Pokrywające chromosomowe szczotki włosie tworzone przez cząsteczki Ki-67 trzyma zatem chromosomy na dystans, nie pozwalając im się skleić (czysto mechaniczny efekt szczotki wzmaga tu dodatkowo ładunek elektryczny białka). Im więcej Ki zresztą, tym większy dystans.
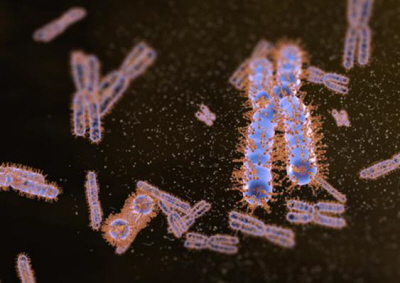
Co więcej, to wcale jeszcze nie wszystko. Jakby mało było zwykłej tworzonej przez Ki bariery mechanicznej, zespół badawczy wytknął Ki-67 jeszcze jeden dodatkowy aspekt czyniący to białko szczególnie interesującym. Sara Cuylen wspomniała pewną istotną cechę budowy jego cząsteczki – jeden z końców przyciągany miał być do chromatyny (niejako kotwicząc Ki w chromosomie), drugi – odpychany od niej (z powinowactwem do cytoplazmy). Taka dwoistość cząsteczki, jej amfifilowość, w połączeniu z cechami fizycznymi i ładunkiem elektrycznym białka skojarzyła się ekipie naukowej z surfaktantami, związkami powierzchniowo czynnymi. Takie amfifilne związki mogące jednocześnie oddziaływać ze środowiskami o diametralnie odmiennych cechach potrafią tworzyć na granicy faz warstewki, pęcherzyki, micele, liposomy. I bywają naprawdę istotne biologicznie. Spośród najistotniejszych dla biologii człowieka surfaktantów możecie kojarzyć chociażby ten (składający się z fosfolipidów i wytwarzany przez pneumocyty typu II) zapobiegający zapadaniu się i sklejaniu pęcherzyków płucnych.
A co w tym niezwykłego, że Ki-67 przypomina surfaktanty, skoro wiemy, że organizm może surfaktanty wytwarzać? Cóż, nie spodziewano się, że białka mogą działać w taki sposób także wewnątrzkomórkowo. Posłuchajmy tym razem Daniela Gerlicha z zespołu badawczego:
Wewnątrz komórek zawiera się wiele różnych kompartmentów (przedziałów), które nie są specjalnie wydzielone błonami i dotąd nie wiedzieliśmy w jaki sposób przedziały te zachowują swoją odrębność przestrzenną. Poszukiwanie kolejnych białek o cechach przypominających surfaktanty i zgłębianie ich potencjalnej roli w utrzymaniu organizacji przestrzennej komórki zapowiada się naprawdę ekscytująco.
Cóż, najfajniejsze badania zawsze prowadzą do dalszych nowych pytań i wyzwań, prawda?
(Przypominam tylko, że patologów możecie śledzić też na fejsbuku – warto tam zaglądać, bo strona jest codziennie aktualizowana)
Literatura:
Ki-67 acts as a biological surfactant to disperse mitotic chromosomes. S Cuylen, C Blaukopf, AZ Politi, T Müller-Reichert, B Neumann, I Poser, J Ellenberg, AA Hyman, DW Gerlich; Nature 2016; 2016 Jun 29; doi: 10.1038/nature18610 [Epub ahead of print]
Cell division: A sticky problem for chromosomes. CP Brangwynne, JF Marko; Nature 2016; 2016 Jun 29; doi:10.1038/nature18904

| Chief editor: | Hili |
| Webmaster:: | Andrzej Koraszewski |
| Collaborators: | Jacek Chudziński, Hili, Małgorzata Koraszewska, Andrzej Koraszewski, Henryk Rubinstein |