Genetyczny przełącznik CRISPR
Nadal jednak jesteśmy na stromej krzywej uczenia się o tej potężnej technologii i badacze właśnie poinformowali o, być może, największym postępie od 2013 roku – znaleźli sposób użycia CRISPR jako przełącznika on-off dla genów. To, co najmniej zrewolucjonizuje badania genetyczne. Ma jednak także niesłychany potencjał terapeutyczny, chociaż pozostają inne przeszkody do zastosowania tego do żywych organizmów.
Używanie CRISPR-Cas9 do edytowania genów ma zasadniczo dwie postaci: wstawianie genów i wyłączanie genów. Wyłączanie jest bez porównania łatwiejsze. CRISPR nacelowuje na gen, który ma zostać wyciszony lub wyłączony i Cas9 przecina obie nici DNA. Naturalny mechanizm naprawczy komórek o nazwie naprawa poprzez scalanie niehomologicznych końców DNA (NHEJ), łączy przecięte końce. Ten mechanizm naprawczy jest jednak bardzo nieprecyzyjny i często wprowadza błędy. Wiele z tych błędów powoduje przesunięcie się genetycznej sekwencji, skutecznie wyłączając gen. Ta zmiana jest trwała i będzie przenoszona do wszystkich późniejszych pokoleń.
Wstawianie genu jest trudniejsze. Nie tylko musisz przeciąć w pożądanym miejscu, ale musisz dostarczyć sekwencję genu, jaką chcesz wstawić i potrzebujesz innego mechanizmu naprawy DNA o nazwie homologiczna naprawa bezpośrednia (HDR), która jest bardziej precyzyjna i zachowuje genetyczną sekwencję, tak że gen pozostaje aktywny. NHEJ jest jednak znacznie powszechniejszy niż HDR, sztuką jest więc znalezienie sposobu na wzmocnienie naprawy HDR, żeby można było z powodzeniem wstawić nowy gen w miejsce naprawy.
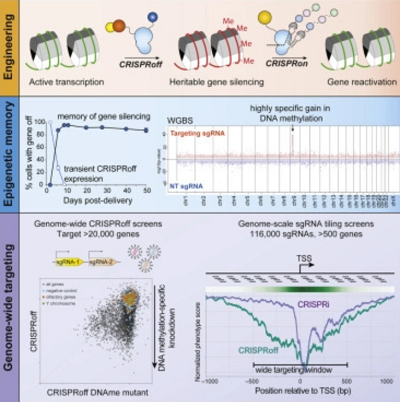
Ta nowa technika stosuje się tylko do wyłączania genów (nie do wstawiania) i w rzeczywistości w ogóle nie zmienia sekwencji DNA. Z tego powodu ta zmiana jest uważana za zmianę epigenetyczną. W tym wypadku CRISPR łączy się z innym ładunkiem, którym jest, jak mówi opublikowane badanie: “pojedyncze białko fuzyjne Cas9”, co razem nazwali CRISPRoff. Ten system celuje, jak zwykle, w konkretny gen, ale zamiast przecinać DNA, metyluje gen – dodaje grupy metylowe do niektórych par zasad. To zazwyczaj uniemożliwia enzymowi transkryptazy pracę z DNA w tym miejscu, a więc gen nie może być transkrybowany i nie powstaje białko. Gen jest skutecznie wyłączony, mimo że sekwencja jest zachowana.
W pracy nad tą technologią badacze poczynili inne ciekawe odkrycia. Pierwszym jest to, że metylacja przechodzi przez kolejne pokolenia, jak długo ją badali. Przyglądali się pluripotentnym komórkom macierzystym i zamieniali je w neurony przez wyłączanie pewnych genów. Metylacja trwała w kolejnych pokoleniach powstałych z tego neuronów. To znaczy, że każde wyciszenie genu dokonane przez CRISPRoff jest “semi permanentne”.
Dokonali także bardzo zaskakującego odkrycia – poprzednio sądzono, że ten mechanizm metylacji będzie działał tylko na pewne geny, które zawierają kanoniczne wyspy CpG (CGI), a stanowią one około jednej trzeciej wszystkich genów. Technika CRISPRoff działała jednak na większość badanych genów, włącznie z tymi, którym brak CGI. To znaczy, że nasze poprzednie rozumienie metylacji było pod tym względem błędne i że CRISPRoff można używać na niemal wszystkich genach. Oba te zaskakujące odkrycia podniosły potencjał CRISPRoff.
Ponadto badacze stworzyli CRISPRon, inny system, który usuwa metylację, włącza z powrotem gen bez żadnego uszkodzenia ani zmiany. Tak więc badacze mają teraz stosunkowo niedrogą i szybką metodę do odwracalnego włączania i wyłączania genów, którą można stosować do większości genów. Wyłączanie genu jest główną metodą, jakiej badacze używają do analizowania jego funkcji – wyłącz gen i zobacz, jakie skutki to ma na komórkę lub na badany układ. To z pewnością jest kolejnym czynnikiem wzmacniającym badania genetyczne, może równie wielkim, jak sam CRISPR. Badania genetyczne rozwijały się przez ostatnie pół wieku w postępie geometrycznym, a nie liniowym. Jest tak częściowo z powodu tego, że nasze zrozumienie genetyki ulepsza samą technologię badań genetycznych, a więc jest pozytywne sprzężenie zwrotne. CRISPRoff jest tego wspaniałym przykładem.
Ta metoda prawdopodobnie nie będzie używana do tworzenia GMO, którego celem jest zmiana DNA w trwały i stabilny sposób – by czynić zmiany genetyczne, a nie epigenetyczne. Mogę się jednak mylić. Niektóre GMO tworzy się tylko przez wyciszenie jednego lub więcej genów, a nie przez wstawianie nowych genów. Fakt, że te zmiany mogą nie być trwałe, może nawet być ciekawą metodą ochrony patentów.
A co z zastosowaniem terapeutycznym? CRISPRoff miałby tutaj niewiarygodny potencjał. Za każdym razem, kiedy wyłączenie genu w danej populacji komórek miałoby korzystne efekty, ta technologia mogłaby działać. Przykładem, jaki przedstawiono jak dotąd, jest choroba Alzheimera. Część postępowania tej choroby powoduje nabudowywanie się białka tau w neuronach. Gdyby dało się znacząco zmniejszyć ekspresję białka tau w komórkach mózgowych, mogłoby to spowolnić lub nawet zatrzymać chorobę.
Pozostaje jednak wielka trudność – jak docierać do żywych komórek w całym organizmie? Te techniki działają świetnie w hodowlach komórkowych w probówce, ale nie mamy jeszcze dobrego mechanizmu do dostarczania CRISPR do docelowej populacji komórek w żywym stworzeniu. To jest zbyt duży temat, by poruszać go dzisiaj, wystarczy więc powiedzieć, że jest kilka proponowanych metod, z których każda ma potencjał. Żadna jednak nie jest wspaniała. Mają problem z dotarciem do wystarczającej liczby komórek docelowych i z unikaniem wpływania na komórki, które nie są ich celem. Jak dotąd używanie CRISPR w celach terapeutycznych dotyczy wyjmowania komórek z ciała, zmieniania ich przy pomocy CRISPR, a następnie wkładanie ich z powrotem. To działa dla krwi lub szpiku kostnego, ale nie będzie działało dla mózgu. Niektóre tkanki mogą być łatwiejsze, takie jak siatkówka. Moglibyśmy, na przykład, wstrzyknąć CRISPR do płynu w oku, który jest w kontakcie z siatkówką. Inne narządy nie są jednak tak oddzielone i byłoby trudno wycelować w nie w ten sposób. Może dałoby się wycelować w mózg przez płyn rdzeniowy?
Sama technologia CRISPR rozwinęła się znacznie bardziej niż jej terapeutyczne zastosowania, częściowo dlatego, że badania na żywych ludziach są trudniejsze i dużo wolniejsze. Dopiero w przyszłości zobaczymy terapeutyczny potencjał CRISPR i może okazać się, że jest bardziej ograniczony niż mieliśmy nadzieję.
Tak czy inaczej, CRISPRoff jest zdumiewającym osiągnięciem i co najmniej będzie potężnym narzędziem badawczym.
A CRISPR Genetic On-Off Switch
NeuroLogica Blog, 13 kwietnia 2021
Tłumaczenie: Małgorzata Koraszewska
Neurolog, wykładowca na Yale University School of Medicine. Przewodniczący i współzałożyciel New England Skeptical Society. Twórca popularnych (cotygodniowych) podkastów o nauce The Skeptics’ Guide to the Universe. Jest również dyrektorem Science-Based Medicine będącej częścią James Randi Educational Foundation (JREF), członek Committee for Skeptical Inquiry (CSI) oraz członek założyciel Institute for Science in Medicine. Prowadzi blog Neurologica.