Ewolucja „nieredukowalnie złożonych” białek zapobiegających zamarzaniu u ryb polarnych (i policzek wymierzony Behemu)
Kliknij na link pod zrzutem z ekranu, żeby przeczytać artykuł; odnośnik jest pod spodem, a pdf tutaj.
Molekularne mechanizmy i rekonstrukcja szlaku ewolucyjnego są skomplikowane, ale spróbuję przedstawić to krok po kroku. (Pamiętajcie, że to jest skomplikowane i mogę coś pomylić, ale będę starał się najlepiej jak potrafię). Zhuang i in. et al. użyli znanej filogenezy ryb spokrewnionych do „niezamarzających” ryb z rodziny Gadidae, grup dorszowatych. Te dorsze mają funkcjonalne glikoproteiny zapobiegające zamarzaniu (AFGPs), które nie pozwalają ich krwi na zamarzanie, kiedy dorsze pływają w bardzo zimnych wodach polarnych. Białka robią to przez nie dopuszczanie do tworzenia się kryształków lodu i działania jako miejsca nukleacji, które mogłyby zamienić rybę w rybne lody.
AFGP ryby składa się z trzech kawałków: sam ”przeciwzamarzacz”, który składa się z powtarzającej się sekwencji aminokwasów treoniny-alaniny-alaniny (Thr-Ala-Ala), drugie wydzielnicze białko, które daje sygnał genomowi, by umożliwił wydzielenie do krwi białka zapobiegającego zamarzaniu i regionu promotorowego, który jest niezbędny, by sekwencja DNA została transkrybowana do RNA (który następnie wytwarza białko zapobiegające zamarzaniu).
Niezwykłe w tej konfiguracji jest to, że każdy jej kawałek, włącznie z dwoma białkami i sekwencją promotorową, zostały sklecone razem poprzez translokację i duplikację DNA (to dzieje się biernie w genomie) aż wszystkie elementy były na miejscu. A „funkcjonalny” gen nie mógł funkcjonować aż do samego końca, kiedy sekwencja promotorowa przesunęła się na właściwe miejsce, by produkować transkrypcję RNA. Całą tę serię kroków zrekonstruowano przez sekwencjonowanie DNA krewnych, którzy nie mają funkcjonalnego AFGP, więc mogliśmy widzieć ewolucyjną kolejność, w jakiej elementy były zestawiane i skąd pierwotnie pochodziły funkcjonalne odcinki.
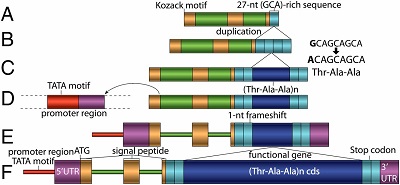
Tutaj jest przedstawione, jak to zachodziło. Podpis z artykułu:
Zakładane etapy ewolucyjne (z założeniem popartym przez analizę sekwencji i filogenezy) to A-F. Najpierw była u przodka sekwencja GCAGCAGCA, która normalnie koduje powtarzające się alaniny, ale nie była funkcjonalna (to znaleziono u krewnego). Rozszerzyła się przez duplikację: A —>B.
Następnie mutacja z guaniny w cytozynę u innego przodka zamieniła jedną sekwencję Ala-Ala-Ala w trójkę aminokwasów Treonina-Alanina-Alanina, która sama rozszerzyła się przez kolejne duplikacje (B —>C). Gen miał teraz cztery jednostki Thr-Ala-Ala, ale nadal był niefunkcjonalny. Miał jednak zostać trzonem funkcjonalnego białka w przyszłości; to jest ciemnoniebieski odcinek widziany od C do F powyżej.
Inna część genomu miała niefunkcjonalną sekwencję, która mogła służyć jako białko wydzielnicze, by spowodować wydzielanie ciemnoniebieskiego białka do krwi. Delecja [usuniecie] jednego nukleotydu (C—>E) umożliwiła tej sekwencji produkowanie białka sygnałowego (liliowy kawałek na D-F). Cały układ był jednak nadal niefunkcjonalny, bo brakowało mu regionu promotorowego.
Wreszcie układ stał się funkcjonalny, kiedy protogen przesunął się bliżej niefunkcjonalnego regionu DNA, gdzie mógł służyć jako promotor powstającego genu. Teraz gen produkujący powtarzające się białko Thr-Ala-Ala mógł funkcjonować i wydzielać je do krwi.
Ponadto, dobór naturalny mógł też działać na funkcjonujący gen, by podnieść jego wydajność po prostu przez dobór tych genów, które miały więcej duplikacji odcinka Thr-Ala-Ala, a więc mieliśmy duże białko powtarzających się jednostek, które mogło działać jako „przeciwzamarzacz” w krwi ryby (E—>F). (Więcej powtórzeń = lepsza ochrona przed zamarzaniem.)
Jest to trochę bardziej skomplikowane niż to, co pokazałem, ale w zasadzie w ten sposób powstało końcowe białko. I nie są to spekulacje, ponieważ wszystkie kawałki można znaleźć w innych gatunkach lub założyć, że były u przodków, a więc ta rekonstrukcja jest całkiem solidna. Ponadto, obejmuje procesy, których działanie w DNA jest znane: przesuwanie odcinków przez translokacje, duplikacja sekwencji itd. Nie wymagało to żadnej boskiej interwencji, mimo że białko nie jest funkcjonalne dopóki nie zostanie zestawione z białkiem wydzielniczym i promotorem.
Można zadać rozsądne pytanie: “No cóż, jeśli powstające białko-przeciwzamarzacz po prostu siedziało tam i nic nie robiło przed aktywacją, to dlaczego nie zostało unieczynnione przez mutacje?” To jest dobre pytanie i jedną z odpowiedzi jest to, że proces odbył się stosunkowo szybko, a więc mutacje (które przecież są rzadkie) nie miały czasu na zamianę ciemnoniebieskiego białka w bełkot. A kiedy już istniał trzon, duplikacja Thr-Ala-Ala była prawdopodobnie szybka, faworyzowana przez dobór naturalny, bo więcej powtórek daje większą działalność przeciwko zamarzaniu.
Mamy więc tutaj „nieredukowalnie” złożony system, funkcjonalny jako przeciwzamarzacz dopiero na samym końcu, ale stworzony przez czysto naturalne i dobrze znane procesy. Żaden Bóg lub kosmiczny projektant nie są wymagani. Jest to dobry przykład tego, jak ciężka praca (sekwencjonowanie i filogenetyczna rekonstrukcja) mogą rozproszyć zastrzeżenie „nie rozumiemy, jak ten nieredukowalnie skomplikowany układ powstał, a więc musiał to zrobić Bóg”.
Cały artykuł, poza tym, że to wspaniała robota, jest policzkiem dla zwolenników Inteligentnego Projektu, takich jak Michael Behe—rybnym policzkiem, jak poniżej:
__________
Zhuang, X., C. Yang, K. R. Murphy, and C.-H. C. Cheng. 2019. Molecular mechanism and history of non-sense to sense evolution of antifreeze glycoprotein gene in northern gadids. Proceedings of the National Academy of Sciences 116:4400-4405.
The evolution of ’irreducibly complex’ antifreeze proteins in a polar fish (and a fish slap at Behe)
Why Evolution Is True, 14 marca 2019
Tłumaczenie: Małgorzata Koraszewska
Profesor (emeritus) na wydziale ekologii i ewolucji University of Chicago, jego książka "Why Evolution is True" (Polskie wydanie: "Ewolucja jest faktem", Prószyński i Ska, 2009r.) została przełożona na kilkanaście języków, a przez Richarda Dawkinsa jest oceniana jako najlepsza książka o ewolucji. Jerry Coyne jest jednym z najlepszych na świecie specjalistów od specjacji, rozdzielania się gatunków. Jest wielkim miłośnikiem kotów i osobistym przyjacielem redaktor naczelnej.