Po raz pierwszy użyto edytowania genów CRISPR do leczenia zaburzenia genetycznego – anemii sierpowatej
Ta medyczna interwencja, która może ostatecznie nie udać się, jest niemniej pierwsza, przynajmniej według artykułu NPR. Nie jestem całkiem pewien, że istotnie jest pierwsza, popatrzcie więc na dyskusję poniżej. „Precedensowy” aspekt nie jest jednak ważny. Ważne jest to, że jeśli ta terapia działa, to otwiera całą nową panoramę leczenia zaburzeń genetycznych.
CRISPR, jak opisałem w recenzji z książki w 2017 roku w „Washington Post”, jest metodą precyzyjnego edytowania genów, która wyrosła z badań podstawowych: obserwacji dziwnych, powtarzających się sekwencji w bakteryjnym DNA. Te powtarzające się sekwencje okazały się być zmagazynowanym wirusowym DNA, którego bakteria używa do precyzyjnego cięcia najeźdźczych wirusów, których DNA odpowiada zmagazynowanym sekwencjom.
Dzięki tej obserwacji cała grupa ludzi, jak to opisałem w moim artykule, rozwinęła CRISPR jako system do edytowania DNA w wielu organizmach, a teraz używa się go do edytowania DNA u ludzi. CRISPR jest niezwykłą technologią, której – kiedy działa poprawnie, a nie zawsze tak jest – można użyć do wycięcia z DNA organizmu wadliwego genu lub części wadliwego genu i zastąpienia go normalnie funkcjonującym genem. Można tego użyć do zmiany DNA na dowolny sposób, jaki chcesz: do wstawienia pożądanych genów do roślin uprawnych lub zwierząt, do zmiany DNA w zamrożonym embrionie twojego potomka, żeby mu, na przykład, dać brązowe oczy zamiast niebieskich. Teoretycznie jest możliwe zmienienie zarówno DNA w gametach (plemniku i jajeczkach) tak, by zmiana była na trwałe dziedziczona przez potomków, albo też zmienić DNA w samym organizmie w sposób, który nie jest dziedziczony.
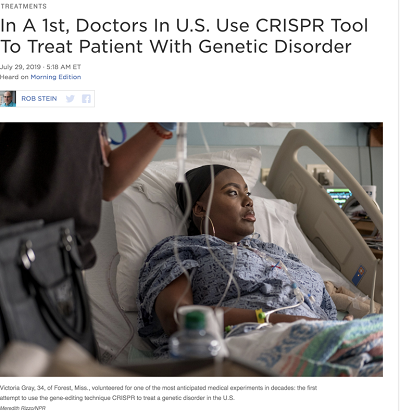
Tę ostatnią metodę zastosowano w próbie wyleczenia z wyniszczającej choroby, anemii sierpowatej. Pacjentką jest Afro-Amerykanka, Victoria Gray (34 lata) z Mississippi, leczona w Nashville. Z czasem terapii podda się 45 innych pacjentów w wieku od 18 do 35 lat. Nie ma na razie wyników, ale jeśli to zadziała, będzie to pierwszy krok ku leczeniu rozmaitych chorób genetycznych. (Choroby muszą polegać na zmianach w DNA, ponieważ CRISPR działa przez zastąpienie jednego genu innym.)
W tym wypadku chorobę powoduje nieprawidłowa budowa hemoglobiny (patrz poniżej): zastąpienie jednego aminokwasu (kwasu glutaminowego w normalnej hemoglobinie, Hb-S), a jest to spowodowane przez zmianę w jednym nukleotydzie w DNA, kodującym łańcuch β hemoglobiny. (Cząsteczka hemoglobiny ma dwa łańcuchy α i dwa β.) Ta zmiana jest mutacją z kodonu GAG, który koduje kwas glutaminowy, na GTG, który koduje walinę. Gen β-hemoglobiny jest na chromosomie 11 (mamy 46 chromosomów, w 23 parach).
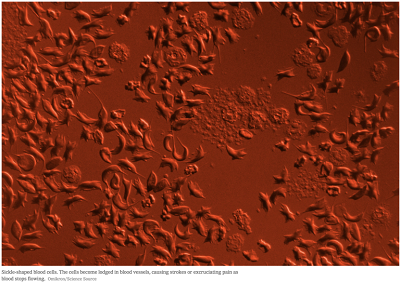
Ta jedna zmiana nukleotydu spośród 3,3 miliarda w naszym genomie daje wyniszczającą chorobę, ponieważ zmutowana hemoglobina powoduje, że czerwone krwinki przybierają sierpowaty kształt, dając cały zespół osłabiających i bolesnych objawów: zniszczenie stawów, udary (sierpowate komórki zatykają układ krążenia), uszkodzenia śledziony, anemię i infekcje. Większość chorych umiera wkrótce po czterdziestce.
Olbrzymia przewaga Afro-Amerykanów wśród chorych w USA jest ważna, ponieważ anemia sierpowata występuje niemal wyłącznie wśród ludów o zachodnioafrykańskim pochodzeniu.
Jest to słynna historia ewolucyjna: gen anemii sierpowatej, kiedy w organizmie jest tylko jedna jego kopia obok „normalnego” genu, nie powoduje choroby, ponieważ tworzy się wystarczająco dużo normalnych czerwonych krwinek, by zapobiec chorobie. Chorujesz tylko jeśli odziedziczysz dwie kopie genu “Hb-S” . Innymi słowy, geny dające chorobę działają jako „recesywne”. Niemniej wielu ludzi w Afryce subsaharyjskiej i Indiach cierpi na tę chorobę: ocenia się, że na całym świecie dotkniętych jest cztery miliony ludzi, a 43 miliony jest „nosicielami” – ludźmi, którzy nie mają objawów, bo mają tylko jedną kopię zmutowanego łańcucha β w swoim DNA.
Dlaczego tak wyniszczający gen trwa w populacji? Dlaczego dobór naturalny nie zredukował częstotliwości jego występowania niemal do zera? Jest tak, ponieważ jeśli jesteś nosicielem jednej kopii i nie chorujesz, zmniejsza to twoje ryzyko śmierci z powodu malarii w stosunku do ludzi z dwoma „normalnymi” genami. Nie jest jasne, dlaczego tak jest, ale z pewnością ma to coś wspólnego ze zmienionym środowiskiem hemoglobiny we krwi, co redukuje wzrost malarycznych pierwotniaków. (Komary, działające jak lotne strzykawki, przenoszą pierwotniaki z człowieka na człowieka.) Tak więc dostosowanie reprodukcyjne (oceniane według przeżycia) trzech typów wygląda następująco: HbS/HbA (heterozygota) jest najlepiej dostosowana, ponieważ nie ma choroby i jest chroniona przed malarią (która często jest śmiertelna); HbA/HbA (normalne homozygoty) mają wysokie, ale trochę niższe dostosowanie, (ponieważ mogą chorować na malarię); i typ HbS/HbS jest genotypem z anemią sierpowatą, większość nie ma dzieci, bo są bardzo chorzy.
Okazuje się, że “heterozygota” ma w tym wypadku najwyższe dostosowanie, więc obie postaci genu są zachowane w populacji niezależnie od tego, że w każdym pokoleniu rodzi się pewna liczba ludzi z HbS/HbS, którzy są skazani na cierpienie i śmierć. To pokazuje, że genetyka i biologia nie tworzą optymalnej sytuacji czyli nie wszyscy są heterozygotami. Jest to jednak niemożliwe, bo natura genetyki dyktuje, że heterozygoty segregują te dwa allele w każdym pokoleniu. Ewolucyjna dynamika korzyści dla heterozygot utrzymuje zły gen w populacji: wielu nosicieli jest chronionych przed malarią,ale 25% potomstwa dwojga takich nosicieli choruje na anemię sierpowatą.
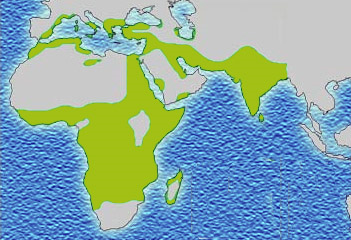
Gen Hb-S znajduje się więc na ogół tam, gdzie śmiertelna malaria jest endemiczna: w zachodniej Afryce i w Indiach (oraz w częściach Bliskiego Wschodu).
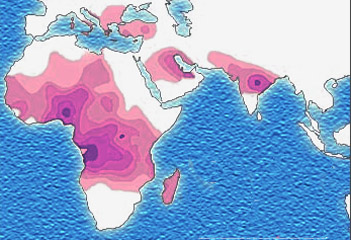
Zbieżność dystrybucji endemicznej malarii (pierwsza ilustracja) z dystrybucją allelu Hb-S (druga ilustracja) jest uderzająca i jest kolejnym dowodem, że obecność malarii jest odpowiedzialna za ewolucyjne utrzymywanie się szkodliwego allelu Hb-S:
Ponieważ czarni ludzie w Ameryce pochodzą głównie od zachodnich Afrykanów sprowadzonych tutaj jako niewolnicy, gen trwał w populacji i dlatego Afro-Amerykanie są niemal jedynymi ludźmi w USA, którzy chorują na anemię sierpowatą. (Częstotliwość genu spada jednak, ponieważ malaria nie jest endemiczna w USA – eliminując ewolucyjną przewagę nosicieli genu – a także małżeństwa z białymi zredukowały jego częstotliwość wśród czarnych).
Tę historię wszyscy opowiadamy nauczając o ewolucji, ponieważ jest to jeden z bardzo nielicznych wypadków, jakie znamy, w których heterozygota dla jednego genu jest lepsza niż każda z homozygot.
Anemia sierpowata jest niemal nieuleczalna, chociaż u niektórych ludzi przeszczep szpiku może się jej pozbyć. Jest to jednak bolesny proces i często nie udaje się. Obecnie badacze pobrali komórki macierzyste pacjentki z anemią sierpowatą. Te komórki mogą zróżnicować się w szpik kostny, który produkuje czerwone krwinki. Badacze zmieniają DNA tych komórek przy pomocy CRISPR i wstrzykują je z powrotem pacjentce, mając nadzieję, że osiądą w kościach i będą produkowały normalne czerwone krwinki, eliminując chorobę. Artykuł NPR poniżej (kliknij na zrzut z ekranu) opisuje terapię otrzymaną przez panią Gray.
Można by sądzić, że edytują sam gen hemoglobiny β, by zamienić paskudny kodon GAG w GTG, ale używają innej taktyki. Najpierw zabijają chemioterapią szpik kostny pacjentki, pozbywają się komórek, które produkują krwinki sierpowate, a potem zastępują je genetycznie zmienionymi komórkami macierzystymi, by pozwolić płodowej hemoglobinie (pierwszej hemoglobinie, jaką produkujemy, która normalnie ustaje w wieku czterech miesięcy) na przetrwanie. Mają nadzieję, że ta płodowa hemoglobina będzie działała jak Hb-A i wyleczy chorobę. Nie jestem pewien, dlaczego robią raczej to niż wstrzyknięcie komórek macierzystych z edytowanym kodonem GTG w genie hemoglobiny β, ale musi być łatwiej używać zmodyfikowanej hemoglobiny płodowej niż edytować gen anemii sierpowatej.
Jeśli to zadziała, a oczywiście może się nie udać (zabicie szpiku kostnego może zabić pacjentkę, wstrzyknięte, zmienione komórki macierzyste mogą nie przyjąć się, itd.) będzie to rewolucja i użycie tej obiecującej nowej technologii do złagodzenia wielkiego cierpienia. Trzymam palce.
Artykuł poniżej, który pojawił się w styczniu, wyjaśnia, dlaczego leczenie Victorii Gray może nie być naprawdę pierwsze. Jest pierwszym użyciem zmienionych przy pomocy CRISPR komórek pobranych od pacjenta, by wyleczyć anemię sierpowatą, ale nie jest pierwszym użyciem płodowych, produkujących hemoglobinę komórek do leczenia choroby. Także zmienione przy pomocy CRISPR komórki użyto do leczenia pacjentów z inną chorobą genetyczną – powodująca ślepotę – podobno z pewnym sukcesem.
Istnieje więc pewne zamieszanie co do tego, czy Victoria Gray rzeczywiście jest pierwsza, ale to nieważne. Jest możliwe, że jest pierwszą pacjentką z anemią sierpowatą, która otrzyma zmodyfikowane przez CRISPR komórki w próbie zastąpienia jej wadliwej hemoglobiny rodzajem hemoglobiny (płodowej), która może działać. Mam żarliwą nadzieję, że tak będzie i że uwolni ją to od choroby, z którą zmaga się od dzieciństwa. A potem dziesiątki tysięcy pacjentów będą mogły otrzymać tę terapię, choć oczywiście, nie zadziała to u wszystkich.
CRISPR, jak powiedziałem w mojej recenzji, niesie olbrzymią obietnicę leczenia chorób genetycznych, a nawet wyeliminowania ”chorobowych genów” z linii zarodkowej (plemników i jajeczek). Zawiera także obietnicę genetycznego modyfikowania roślin i zwierząt, choć uważane jest za nieetyczne używanie tej metody do eugenicznych manipulacji u ludzi, jak na przykład dawania dzieciom wyższego wzrostu lub większej inteligencji. Ale to i tak nie działałoby zbyt dobrze, ponieważ cechy takie jak wzrost i inteligencja, na tyle, na ile są genetyczne, opierają się na wielu genach, a nie da się edytować ich wszystkich. Ani też ta terapia nie byłaby użyteczna dla chorób wielogenowych, takich jak nadciśnienie rodzinne, które także opiera się na wielu genach. Ale dla chorób spowodowanych jednym genem, takich jak anemia sierpowata lub choroba Huntingtona, CRISPR jest właściwym podejściem.
I ostatnia lekcja: CRISPR, z wszystkimi korzyściami i obietnicami, wyłonił się z badań podstawowych: pozornie przyziemnego sekwencjonowania bakteryjnego DNA. Konsekwencje tej pracy były absolutnie nieprzewidywalne.
Nigdy nie wiadomo, jakie korzyści dla ludzkości mogą pojawić się z takich badań podstawowych. Już to samo jest powodem, by finansować badania podstawowe, które nie są skierowana bezpośrednio na poprawienie dobrostanu ludzkości, ale oczywiście, są także inne powody – największym jest to, że wiedza o wszechświecie jest korzyścią samą w sobie, niezależnie od tego, czy czyni nasz gatunek inteligentniejszym, zdrowszym lub wyższym.
h/t: Matthew Cobb
A medical first:CRISPR gene-editing used to treat a genetic disorder – sickle cell anemia
Why Evolution Is True, 1 sierpnia 2019
Tłumaczenie: Małgorzata Koraszewska
Emerytowany profesor na wydziale ekologii i ewolucji University of Chicago, jego książka "Why Evolution is True" (Polskie wydanie: "Ewolucja jest faktem", Prószyński i Ska, 2009r.) została przełożona na kilkanaście języków, a przez Richarda Dawkinsa jest oceniana jako najlepsza książka o ewolucji. Jerry Coyne jest jednym z najlepszych na świecie specjalistów od specjacji, rozdzielania się gatunków. Jest również jednym ze znanych "nowych ateistów" i autorem książki "Faith vs Fakt". Jest wielkim miłośnikiem kotów i osobistym przyjacielem redaktor naczelnej.