Tłuszcz nie sprzyja prostacie
Skoro zatem wchodzą w rachubę hormony płciowe, nie powinny dziwić powiązania między otyłością a nowotworami bezpośrednio z aktywnością tych hormonów związanymi – tu koronnym przykładem jest rak trzonu macicy, czyli rak endometrium. Przy innych nowotworach dochodzą dodatkowe związane z otyłością czynniki pośrednio wpływające na ich rozwój. Ot, przełyk chociażby – otyłość sprzyja chorobie refluksowej, cofanie się kwaśnej treści żołądkowej do przełyku – podrażniając śluzówkę – sprzyja rozwojowi zmian metaplastycznych w nabłonku wyścielającym ściany narządu, co z kolei sprzyja rozwojowi raka gruczołowego. Podobnie jest z kamicą żółciową, której jednym z czynników ryzyka jest nadmierna waga pacjenta właśnie, a sama kamica żółciowa to jeden z czynników przyczyniających się do rozwoju nowotworów pęcherzyka żółciowego.
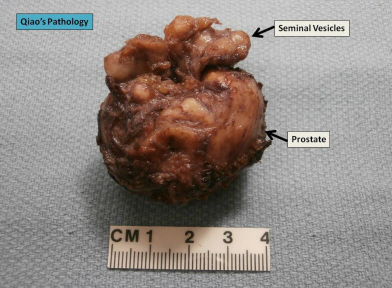
Z prostatą (gruczołem krokowym zwanym też sterczem) rzecz jest nieco bardziej skomplikowana. Statystyki nie są tu aż tak jednoznaczne w kwestii powiązań z otyłością, jak przy raku endometrium, jednak związek wydaje się istnieć. Ale nieco innej najpewniej natury – otóż dane sugerują, że otyłość sprzyja nie tyle rakowi gruczołu krokowego jako takiemu, ile – to nie będzie pozytywna wiadomość – bardziej agresywnym jego postaciom. Co to właściwie znaczy?
Rak prostaty to drugi w kolejności po raku płuc nowotwór złośliwy trapiący polskich mężczyzn. Nie jest jednak drugim w kolejności zabójcą – tu wyprzedza go rak jelita grubego (nowotwory jelita grubego są odpowiedzialne za 12% zgonów nowotworowych u mężczyzn, rak gruczołu krokowego – za 8%). Co więcej, rak prostaty choć bywa prawdziwym utrapieniem, chętnie przerzutując do kości na przykład, jednocześnie niejednokrotnie charakteryzuje się przebiegiem nieomalże łagodnym, dając początek opowieściom o pacjentach umierających nie tyle na raka prostaty, ale po prostu przy okazji z rakiem stercza, owszem, ale de facto z powodów zupełnie innych. Eksperci starają się ujmować te różnice w naturalnym przebiegu choroby w diagnostyce, chociażby ulepszając dostępne klasyfikacje, nadal jednak pozostaje wiele pytań, na które brak nam jednoznacznej odpowiedzi. Być może jedną z takich kwestii udało się właśnie ostatnio rozwikłać.
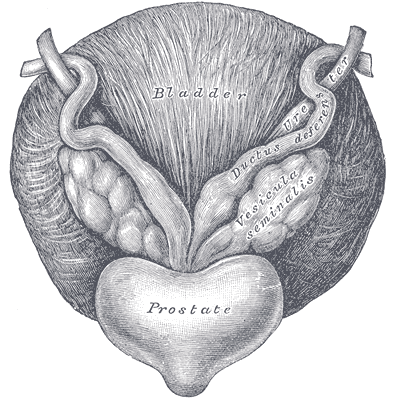
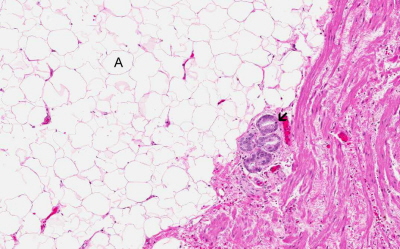
Nature Communications opublikowało rzecz w styczniu tego roku. Otóż badacze wzięli na warsztat kwestię podnoszoną już wcześniej. U otyłych pacjentów mianowicie częściej mamy do czynienia z rakiem prostaty nie tylko o wyższym poziomie złośliwości histologicznej (bardziej zatem agresywnym biologicznie), ale też i bardziej lokalnie zaawansowanym – naciekającym na przykład otaczającą gruczoł krokowy tkankę tłuszczową bądź pęcherzyki nasienne. To właśnie na mechanizmach tym miejscowym naciekaniem sterujących skupili się autorzy pracy. Szczególnie skupili się na rezerwuarze tkanki tłuszczowej najbliższym omawianemu narządowi – na “otulającej” prostatę okołosterczowej tkance tłuszczowej.
Otyłość wiąże się nie tylko z ilością dostępnej tkanki tłuszczowej, ale też – między innymi dzięki towarzyszącemu otyłości ciągłemu, choć niewielkiemu, stanowi zapalnemu – z pewnymi istotnymi zmianami jakościowymi w jej obrębie – dla nas istotne będzie, że u pacjenta otyłego tkanka tłuszczowa wytwarza więcej niż w normalnych warunkach najrozmaitszych lokalnie aktywnych związków chemicznych. Część z nich już wcześniej podejrzewano o potencjalny wpływ na poziom złośliwości samego raka, obecnie kolejne udało się powiązać z kluczowym dla każdego nowotworu momentem, czyli z wyjściem poza narząd macierzysty.
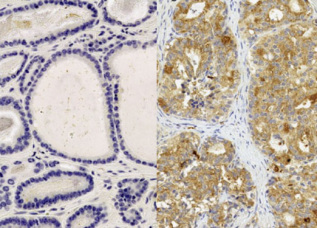
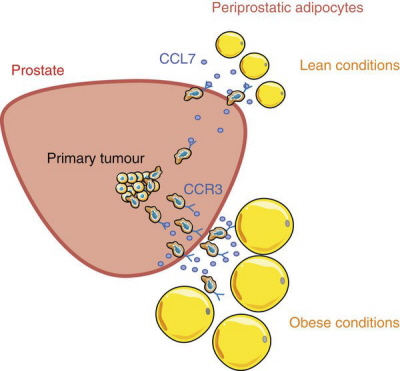
Jedną z obficiej niźli w warunkach fizjologicznych wydzielanych przed adipocyty (komórki tkanki tłuszczowej) otyłego chorego substancji jest CCL7, drobne białko pierwotnie znane ze swej zdolności przyciągania i regulowania funkcji pewnych typów białych krwinek, choć od dłuższego już jednak czasu wiemy, ze nie są to jedyne jego funkcje (a i jego potencjał w najróżniejszych patologiach jest coraz szerzej postrzegany). Dla raka prostaty kluczowe jest tutaj słowo “przyciąganie”. To właśnie zdolność CCL7 do skłaniania pewnych typów komórek do migracji, do wędrówki w kierunku komórek CCL7 wydzielających, okazała się clou sprawy. CCL7 nie przywołuje, oczywiście, aktywnie wszystkiego w okolicy – tak prosto to nie działa, a i efekty mogłyby być cokolwiek ekscentryczne. Jak wszystkie “promigracyjne” białka tego typu (nazywane chemokinami) CCL7 wymaga obecności na powierzchni komórek docelowych odpowiednich receptorów. Nie będziemy się bawić w sztuczne suspensy – i tak niewątpliwie domyśliliście się, że takie receptory udało się autorom artykułu zidentyfikować na powierzchni komórek raka prostaty, prawda?
Jednym z białek receptorowych dla naszej chemokiny CCL7 jest białko CCR3 obecne też na niektórych białych krwinkach i na komórkach nabłonka dróg oddechowych (uważane jest zresztą za potencjalny cel terapeutyczny w leczeniu astmy, choć dotychczasowe badania kliniczne niekoniecznie można uznać za w pełni satysfakcjonujące). CCR3, jak się okazuje, nie tylko na komórkach prostaty daje się znaleźć, ale też jego poziom wydaje się zależeć od poziomu złośliwości samego nowotworu, co stwarza sytuację wprost idealnie pasującą do zależności sugerowanych we wcześniejszych badaniach. Zmieniona w przebiegu otyłości okołosterczowa tkanka tłuszczowa wydziela dużo CCL7, co “wywabia” komórki raka poza gruczoł, przyczyniając się do szybszego rozwoju choroby; co więcej silniej wpływa na komórki nowotworów gorzej zróżnicowanych i bardziej agresywnych zgodnie z opisywaną tendencją, wedle której otyłość sprzyja przede wszystkim rozwojowi takich właśnie raków. Super, zagadka rozwiązana.
No OK, to ostatnie stwierdzenie jest może nieco nazbyt optymistyczne. Wiele zapewne wciąż pozostaje do opisania w relacjach między tkanką tłuszczową a sąsiadującymi z nią narządami (nie tylko w gruczole krokowym doszukujemy się podobnych zależności), a i opisane białka nie są raczej jedynymi biorącymi udział w inwazji raka poza narząd (sugerują to zresztą w pracy sami badacze), na pewno możemy jednak stwierdzić, że o rozwoju raka prostaty dowiedzieliśmy się czegoś nowego, co pozwala uzupełnić wciąż istniejące luki w naszej wiedzy o mechanizmach, dzięki którym nowotwory tak skutecznie potrafią czasem opanowywać zajęte organizmy. I nie jest to cegiełka kosmetycznej li i jedynie wartości. Poza poszerzeniem naszej wiedzy o patomechanizmach leżących u podstaw onkologii zyskaliśmy też potencjalne punkty uchwytu dla ewentualnych nowych terapii. Skoro – jak wspomniałam wyżej – udaje nam się wpływać na CCR3 w przypadku astmy, czemu by nie próbować tego uczynić w raku stercza?
(Przypominam tylko, że patologów możecie śledzić też na fejsbuku – warto tam zaglądać, bo strona jest codziennie aktualizowana)
Literatura:
Overweight, obesity and cancer: epidemiological evidence and proposed mechanisms. EE Calle, R Kaaks; Nature Reviews Cancer 2004;4(8):579-591
Rola tkanki tłuszczowej w układzie dokrewnym. B Skowrońska, M Fichna, P Fichna; Endokrynologia, Otyłość i Zaburzenia Przemiany Materii 2005;1(3):21-29
The 2014 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma: Definition of Grading Patterns and Proposal for a New Grading System. JI Epstein, L Egevad, MB Amin, B Delahunt, JR Srigley, PA Humphrey; The American Journal of Surgical Pathology 2016;40(2):244-52
Periprostatic adipocytes act as a driving force for prostate cancer progression in obesity. V Laurent, A Guérard, C Mazerolles, S Le Gonidec, A Toulet, L Nieto, F Zaidi, B Majed, D Garandeau, Y Socrier, M Golzio, T Cadoudal, K Chaoui, C Dray, B Monsarrat, O Schiltz, YY Wang, B Couderc, P Valet, B Malavaud, C Muller; Nature Communications 2016;12(7):10230
Adipokines in inflammation and metabolic disease. N Ouchi, JL Parker, JJ Lugus, K Walsh; Nature Reviews Immunology 2011;11(2):85-97
Zespół metaboliczny – aktualny stan wiedzy o przyczynach i patomechanizmach. J Pawłowska, JM Witkowski, E Bryl; Forum Medycyny Rodzinnej 2009;3(4):278-291
Periprostatic adipose tissue and prostate cancer progression: new insights into the tumor microenvironment. P Toren, V Venkateswaran; Clinical Genitourinary Cancer 2014;12(1):21-6
Lekarka ze specjalizacją z patomorfologii, pasjonatka popularyzacji nauki, współtwórczyni strony poświęconej nowinkom naukowym Nauka głupcze, ateistka, feministka. Prowadzi blog naukowy Patolodzy na klatce.