Astrocyty tworzą nowe neurony po udarze
Znakomita większość (ok. 80%) udarów to udary niedokrwienne, a ich patomechanizm nie różni się zasadniczo od patomechanizmu zawału serca. Prawidłowa czynność mózgu ściśle zależy od przepływu dostarczającej mu tlenu i glukozy krwi. Zamknięcie światła naczynia doprowadzającego krew do danego rejonu mózgowia (np. przez zakrzep czy materiał zatorowy) powoduje martwicę tego obszaru, jeśli naczynie nie zostanie „odetkane” wystarczająco szybko. A na regenerację zniszczonych komórek nerwowych na razie niestety nie bardzo możemy liczyć.
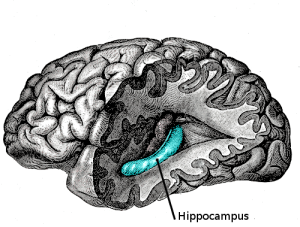
Możliwości neurogenezy, tworzenia nowych komórek nerwowych, są w mózgu dorosłego ssaka nader ograniczone. Zazwyczaj nie wymieniamy starych neuronów na nowe, nasze organizmy nie odtwarzają też zwykle tych uszkodzonych. Mechanizmy regeneracyjne zdołano – owszem – zaobserwować, ale tylko w ściśle wyselekcjonowanych regionach – w zakręcie zębatym hipokampa i pod wyściółką komór bocznych mózgu (od niedawna sugeruje się, że również w sąsiedztwie tego ostatniego obszaru, w obrębie tzw. prążkowia mogą się pojawiać nowe neurony u dorosłych), pojawiały się jednak doniesienia, że do tworzenia nowych neuronów bądź wręcz przekształcania się w nie można skłonić astrocyty, szczególną frakcję komórek glejowych (podstawowy obok neuronów składnik tkanki mózgowej) o charakterystycznym gwiaździstym kształcie. Astrocyty niegdyś uważano za komórki o funkcji głównie strukturalnej (element budowlany, w tym współtworzący barierę krew-mózg) i odżywczej. Obecnie wiemy już, że pełnią też niezwykle istotne funkcje regulacyjne, zarówno przy modulacji sygnałów nerwowych i metabolizmu neuroprzekaźników, jak i dla funkcjonowania pozostałych komórek gleju. Postulowaną ich rolę w procesach neuroregeneracji postanowili ocenić w warunkach in vivo naukowcy z Karolinska Institute (Szwecja).
Badania przeprowadzono na myszach, u których wywoływano udar poprzez zamknięcie tętnicy środkowej mózgu, a następnie rejestrowano zmiany zachodzące w uszkodzonym prążkowiu. Okazało się, że w obszarze objętym martwicą niedokrwienną już dwa dni po udarze rozproszone astrocyty zaczęły wytwarzać Ascl1, czynnik transkrypcyjny kluczowy dla różnicowania się neuroblastów, macierzystych komórek nerwowych, jednocześnie można było obserwować stopniowe pojawianie się samych neuroblastów. Wytwarzające wspomniany neurogenny czynnik astrocyty mnożyły się i zbierały w grupki, powoli tracąc swoje pierwotne cechy, w zamian nabierając cech komórek nerwowych. Dwa tygodnie po udarze można było obserwować gęsto upakowane skupiska młodych neuroblastów niewykazujących cech, które mogłyby sugerować przywędrowanie z innej niźli prążkowie lokalizacji (ich lokalne pochodzenie potwierdzono dodatkowo przy pomocy specjalnych znaczników transgenicznych), każde skupisko wywodzące się z pojedynczego astrocyta. Ich liczba rosła przez kolejnych pięć tygodni, a część z nich zaczęła dojrzewać, a nawet tworzyć połączenia synaptyczne.
Poza potwierdzeniem neurogennego potencjału astrocytów badaczom udało się też przyjrzeć mechanizmom sterującym zaobserwowanymi przemianami. Okazało się, że w przeciwieństwie do astrocytów zdrowych zwierząt komórki „poudarowe” wykazywały zmniejszoną aktywność szlaków sygnalizacyjnych związanych z receptorem Notch, odpowiedzialnych za blokadę możliwości rozwoju nowych komórek nerwowych. Żeby zweryfikować swoje domysły, naukowcy spróbowali sztucznie wzmóc aktywność tej ścieżki sygnalizacyjnej, co rzeczywiście zahamowało neurogenezę. Co więcej, udało im się także włączyć uśpiony program neurogenezy w astrocytach zdrowych myszy – po zablokowaniu sygnalizacji Notch w prążkowiu zaczęły się pojawiać młode neuroblasty, a dalsze badania pokazały, że podobny potencjał nie jest ograniczony wyłącznie do tego rejonu mózgu.
Badania Szwedów dokumentujące neurogenny potencjał komórek glejowych (poza ustalonymi dotąd obszarami tworzenia nowych komórek nerwowych) i rozszyfrowujące po części mechanizmy tym potencjałem sterujące to być może pierwszy krok na drodze do terapii, które wspomogą procesy odzyskiwania zdrowia chorych po udarach, niewykluczone też, że opisane zjawiska mogą być punktem wyjścia nowych metod leczenia niektórych chorób zwyrodnieniowych – by nie szukać daleko, wystarczy zauważyć, że sami autorzy wspominają chociażby o chorobie Parkinsona. Droga do praktycznych zastosowań jest jeszcze, oczywiście, dość daleka – trzeba ocenić na ile funkcjonalne są nowo powstałe neurony i tworzone przez nie połączenia, zweryfikować w jaki sposób udar mózgu odblokowuje program neurogenezy w astrocytach i od czego zależy stopnień jego aktywacji, sprawdzić czy inne uszkodzenia mózgu mogą włączać podobne ścieżki. Warto też wspomnieć, że aktywowane szlaki są istotne także dla rozwoju niektórych złośliwych nowotworów układu nerwowego.
Tak, to początek ciekawej drogi, która może doprowadzić nas do wielu interesujących miejsc.
Źródło:
A latent neurogenic program in astrocytes regulated by Notch signaling in the mouse. JP Magnusson, C Goritz, J Tatarishvili, DO Dias, EM K. Smith, O Lindvall, Z Kokaia, J Frisen Science, 2014; 346 (6206)
Mechanism that repairs brain after stroke discovered
Jeśli tekst wydaje Wam się znajomy, macie rację. Jego pierwotna wersja ukazała się na portalu Racjonalista.tv
Paulina Łopatniuk
Lekarka ze specjalizacją z patomorfologii, pasjonatka popularyzacji nauki, współtwórczyni strony poświęconej nowinkom naukowym Nauka głupcze, ateistka, feministka. Prowadzi blog naukowy Patolodzy na klatce.
Od Redakcji
Teksty Pauliny Łopatniuk publikowaliśmy już wcześniej, Ten jest jednak wyjątkowy rozpoczyna bowiem stałą współpracę z Jej nowym blogiem naukowym Patolodzy na klatce. Problem z patologami jest poważny, o czym zaświadcza ogłoszenie wywieszone swego czasu w bloku mieszkalnym w jednej z naszych metropolii.
Mamy nadzieję, że „Patolodzy na klatce” będą hitem w całkiem niemałym środowisku tych, dla których informacje z świata nauki są ciekawsze od wielu innych. (Co nie oznacza, że nie spotkamy się tu z teoriami spiskowymi. Patolodzy świadkiem, że nawet bakterie spiskują.)
Nowy blog Pauliny Łopatniuk możecie śledzić również na fejsbuku.